
Catalisadores

Nas últimas décadas, os catalisadores químicos ganharam mais importância face à necessidade premente de otimizar processos e reduzir os impactos ambientais associados à produção industrial e aos avanços tecnológicos.
Esta crescente relevância destaca-se como uma resposta inovadora e essencial para os desafios contemporâneos, posicionando os catalisadores como protagonistas na busca por soluções sustentáveis e eficientes.
Neste site vou explorar dedicadamente e desvendar os segredos e potenciais dos catalisadores, evidenciando o seu papel transformador em diversas aplicações e setores.
O que são catalisadores?
Os catalisadores desempenham o papel de verdadeiros "mágicos" na química, pois são substâncias que aceleram reações químicas sem sofrerem alterações na sua própria estrutura. Como "alquimistas invisíveis", eles desbloqueiam caminhos que possibilitam processos químicos mais velozes e eficazes, em vez de ir por um caminho normal e, consequentemente, mais lento. Não influenciam no rendimento da reação não alterando o equilíbrio químico nem a constante de equilíbrio!
A sua capacidade de atuar como impulsionadores sem serem consumidos durante a reação torna-os protagonistas em uma variedade de cenários, desde laboratórios de pesquisa até aplicações industriais, contribuindo para a eficiência e sustentabilidade em inúmeras áreas da ciência e da indústria.
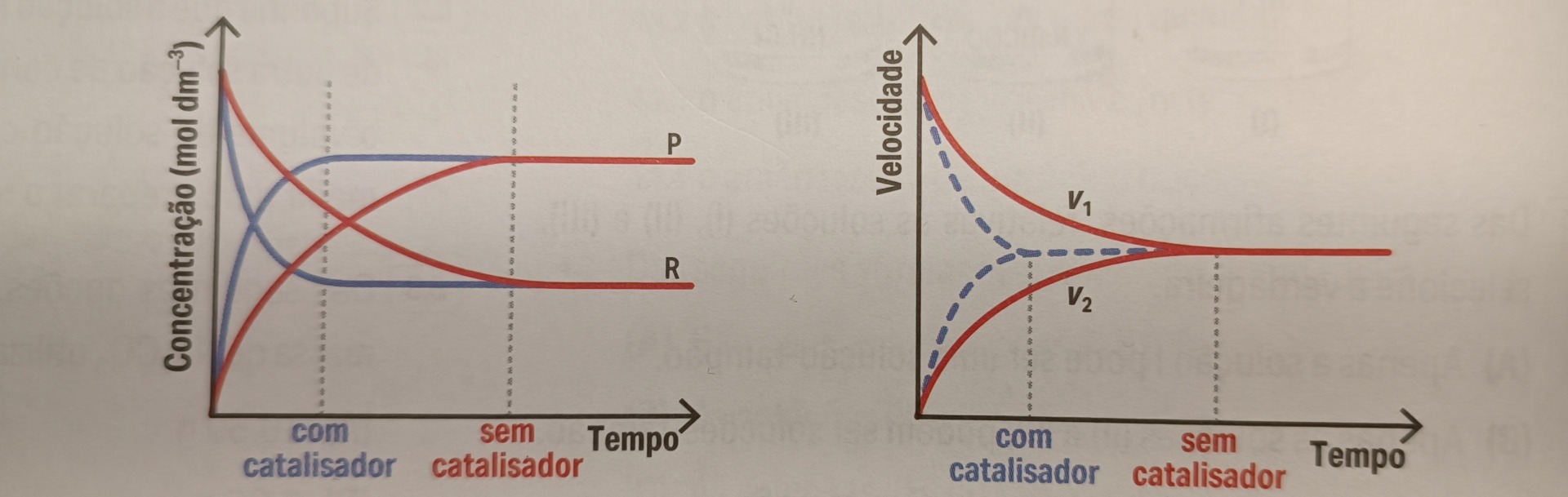
Nesta imagem em baixo podemos observar os esboços de gráficos da evolução da concentração de reagentes e produtos das velocidades das reações direta e inversa com e sem catalisador. A azul, ou seja, com catalisador, atinge o equilíbrio químico mais rapidamente do que sem catalisador.
Tipos de catalisadores:
As categorias principais de catalisadores estão relacionadas à uniformidade do meio reacional e enquadram-se na área de físico-química chamada Cinética Química que basicamente estuda a velocidade das reações químicas e os fatores que a influenciam essa velocidade ou a sua alteração, muitas vezes relacionado ao uso de catalisadores nessas reações desempenhando papéis cruciais em diversos processos químicos e industriais.
Podemos classificar os catalisadores com base na sua interação com os reagentes e no estado físico durante a reação. Essa classificação fundamental divide os catalisadores em duas categorias distintas: homogéneos e heterogéneos.

Se os catalisadores são solúveis nesse meio, a catálise, isto é, a ação do catalisador no sistema reacional, é considerada homogénea, e esses catalisadores são denominados de catalisadores homogéneos, pois o catalisador é do mesmo estado físico que o reagente.
Por outro lado, se a catálise ocorre através de um catalisador insolúvel no meio, ela é classificada como heterogénea, e o catalisador é referido como sendo heterogéneo, pois não é do mesmo estado físico que o reagente, isso pode ocorrer quando o catalisador é sólido e os reagentes estão em um estado físico líquido ou gasoso, por exemplo.
Observemos dois exemplos abaixo de reações químicas onde numa podemos encontrar um tipo de catalisador homogéneo e na outra um catalisador heterógeneo.
Aplicações práticas:
Os catalisadores podem ser aplicados numa grande diversidade de áreas como por exemplo:
- a nível industrial;
- nos automóveis;
- na Química e Biologia, entre outros..
A presença da catálise é onipresente em diversas indústrias químicas. Cerca de 90% dos produtos químicos fabricados comercialmente utilizam catalisadores em alguma fase do processo de produção.
Os catalisadores têm um papel fundamental na síntese do amoníaco a nível industrial.
Observemos a reação de síntese de amoníaco que é também conhecida como síntese de Haber-Bosch, é um processo amplamente utilizado em grande escala na indústria. Nesse método, os ajustes cuidadosos dos parâmetros que influenciam a reação entre nitrogénio e hidrogénio são realizados de maneira ideal para maximizar a produção de amoníaco.
Na verdade, os reagentes N2 e H2 são obtidos, o nitrogénio é obtido do ar atmosférico, visto que 78% do ar atmosférico é contituido de N2, e o hidrogénio como resultado da reação entre a água e o metano.
A síntese de amoníaco é essencial para a produção de fertilizantes nitrogenados, que são fundamentais para a agricultura moderna.
O catalisador utilizado nesta reação é o ferro. A reação de síntese de amoníaco é lenta na ausência de um catalisador.
O ferro (Fe) é frequentemente usado como catalisador nesse processo, aumentando significativamente a taxa de reação, isto é, o consumo de reagentes e consequentemente a rápida formação dos produtos da reação, neste caso, o amoníaco.
A presença do ferro como catalisador contribui para a eficiência global do processo, tornando a produção de amoníaco mais econômica e sustentável, pois a otimização do processo por meio de catalisadores pode levar a uma produção mais limpa e a uma menor geração de resíduos ou subprodutos poluentes.
Logo, a reação de Haber-Bosch é um exemplo fundamental de como os catalisadores desempenham um papel crucial na indústria química, permitindo a produção em larga escala de compostos essenciais para a agricultura e, por conseguinte, para a produção de alimentos.
Nas últimas décadas os catalisadores químicos ganharam mais importância face à necessidade de reduzir as emissões poluentes provenientes dos gases de escape dos automóveis. E é neste fator que os catalisadores têm uma maior importância na indústria automobilista.
Na imagem abaixo, à esquerda podemos observar um catalisador de automóvel, o constituinte metálico mais comum nestes catalisadores é o paládio (Pd), juntamente com o ródio (Rh) e, em alguns casos, a platina (Pt).
Na imagem à direita podemos observar a parte de baixo de um carro onde encontra-se um catalisador instalado e é conhecida como "sistema de escapamento".


Uma reação química crucial em carros é a combustão interna da gasolina. Nesse processo, o catalisador, geralmente um conversor catalítico, desempenha um papel vital. Ele acelera a conversão de gases tóxicos, como monóxido de carbono(CO) e óxidos de nitrogénio(NO), em compostos menos nocivos, contribuindo para a redução da poluição atmosférica e cumprindo normas ambientais. Essa função do catalisador é essencial para a eficiência e sustentabilidade dos veículos.
Os carros elétricos não possuem um sistema de escape como os veículos a combustão, e, portanto, não requerem catalisadores para processar emissões gasosas. A necessidade de catalisadores está principalmente associada a motores a combustão interna.
As regulamentações ambientais geralmente definem a necessidade de catalisadores em carros movidos a combustíveis fósseis. Essas regras variam entre países e são implementadas para reduzir emissões prejudiciais. Carros a gasolina e diesel frequentemente são obrigados a ter sistemas catalíticos para atender a essas normas ambientais e melhorar a qualidade do ar.

Clique no video abaixo para conhecer um pouco mais sobre a função dos catalisadores no automóveis, o motivo desta peça ser tão importante e de grande valor económico.
Saber +
Clique em "Inibidores" para explorar e descobirir alguns aspetos interessantes sobre os chamados "catalisadores negativos".
webgrafia..
https://www.engquimicasantossp.com.br/2012/06/catalisadores.html
https://en.wikipedia.org/wiki/Catalysis
https://www.uol.com.br/carros/faq/catalisador-o-que-e-e-para-que-serve.htm
https://www.catalisajr.com.br/catalisadores-qual-a-importancia-para-a-industria/